Non è la prima volta che l’Agenzia Italiana del Farmaco (AIFA) dispone il ritiro di diversi lotti di farmaci contenenti un determinato principio attivo. Il caso della ranitidina di questi giorni presenta però molte analogie con quello occorso il 23 luglio dello scorso anno con il valsartan. Anche nel 2018 le compresse contenenti l’antiipertensivo antagonista dei recettori dell’ormone dell’angiotensina II (tra i responsabili della vasocostrizione), utilizzato anche per l’insufficienza cardiaca e nei pazienti reduci da infarto del miocardio, riscontrarono la presenza di N-nitrosodimetilammina (NDMA).
NDMA NEI SALUMI E NELLE ACQUE
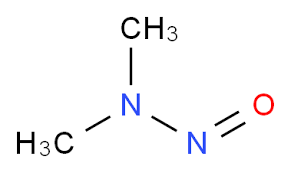
L’NDMA, appartenente alla famiglia delle nitrosammine, è sostanza altamente tossica soprattutto per il fegato dell’uomo e conosciuta come cancerogena negli animali da laboratorio: classificata come potenzialmente cancerogena per l’essere umano. L’NDMA può trovarsi in piccole quantità anche nei salumi, nel pesce nonché nell’acqua che sgorga dai nostri rubinetti domestici. In quest’ultimo caso l’NDMA è possibile sottoprodotto del processo di clorazione derivante dalla clorammina. Il quantitativo considerato ammissibile dall’Agenzia per la Protezione Ambientale statunitense (US Environmental Protection Agency) è 7 nanogrammi per litro.
SHOPPING IN CINA PER BIG PHARMA
Nel caso del valsartan una serie di industrie farmaceutiche occidentali (l’italiana Menarini, la tedesca Sandoz, l’israeliana Teva, la Doc, l’EG ed altre), produttrici non solo di generici, ma anche di “branded”, avevano tutte acquistato la molecola da uno stesso stabilimento localizzato in Cina, il Pharmaceutical Zhejiang Huahai nel sito di Sichuan, Duqiao, Linai .
UN ANNO DOPO STORIA ANALOGA
Come misura precauzionale, l’AIFA e le altre Agenzie europee disposero di conseguenza l’immediato ritiro dalle farmacie e dalla catena distributiva di tutte le confezioni appartenenti ai lotti interessati. Misura analoga è stata adottata venerdì scorso per la ranitidina, antagonista del recettore istaminico H2 presente nello stomaco, utilizzata contro acidità gastrica, problemi di reflusso gastroesofageo e per il trattamento dell’ulcera peptica.
LA RANITIDINA DALL’INDIA
Aziende quali la Menarini, produttrice del principio attivo sotto il brand Ranidil (fiale, compresse e soluzione) e la Ratiopharm (appartenente al gruppo Teva), oltre alla britannica Glaxo Smith Kline, produttrice dell’anti-H2 con il marchio Zantac (iniettabili e compresse), la Hexal ed altre imprese di generici acquistavano la molecola tutte da uno stesso stabilimento, questa volta sito in India: Saraca laboratories ltd di Hyderabad. Il problema è sempre la possibile contaminazione in alcuni lotti di NDMA, segnalata dalla massima autorità sanitaria statunitense (la Food and Drug Administration).
VENDITA SOSPESA PER PRECAUZIONE DI TUTTA LA RANITIDINA
In quest’occasione allo scopo di compiere di ulteriori verifiche l’EMA (l’Autorità Europea del Farmaco), e a cascata le rispettive autorità degli stati membri (AIFA compresa), ha deciso di far sospendere temporaneamente, e non di ritirare in via definitiva le confezioni dai magazzini di farmacie e della catena distributiva, la vendita/dispensazione di tutti i farmaci contenenti ranitidina.
BUSCOPAN ANTIACIDO NON BUSCOPAN
In quest’ultima fattispecie si tratta di medicinali le cui aziende produttrici non hanno acquistato la molecola della ranitidina dallo stabilimento indiano Saraca. In sostanza il buscopan antiacido (non il buscopan e il buscopan compositum), come anche il veterinario zantadine e la ranitidina di altre produttrici i cui lotti non sono finite nella lista dei “197” pubblicata sul sito dell’AIFA, potrebbe non contenere in alcun modo tracce di NDMA. L’Agenzia Italiana del Farmaco si riserva tuttavia a scopo meramente precauzionale di compiere ulteriori approfondimenti sui medicinali fuori lista.
COSA AVVENNE DALLE PARTI DI SICHUAN?
Per il valsartan proveniente dalla Cina la tesi più accreditata è che la contaminazione da NDMA potrebbe essere il risultato di cambiamenti che Zhejiang Huahai apportò al suo processo di produzione nel 2012, utilizzando un metodo per migliorare la resa del prodotto. La società aveva presentato la documentazione della modifica del processo alle autorità. FDA e EDQM (la Direzione Europea per la Qualità del Farmaco) approvarono il processo modificato, ma potrebbero trascurato la potenziale formazione di impurezze genotossiche. Ma quanto era completa e chiara la documentazione presentata alle Autorità per la valutazione della modifica nel processo produttivo? Dolo o mancanza di conoscenza scientifica?
PROCESSO MODIFICATO PER UNA MAGGIORE RESA
Nello specifico per sintetizzare il ciclo del tetrazolo nella molecola di Valsartan, il processo modificato da parte della Zhejiang Huahai è consistito nel sostituire il tributilstagno azide con il composto più tossico, il sodio azide. La resa della formazione di tetrazolo era sicuramente migliore.
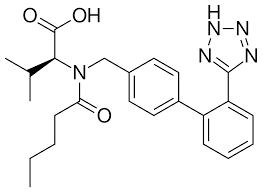
DA NITRITO DI SODIO AD ACIDO NITROSO
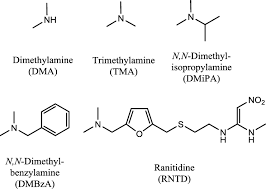
Il nitrito di sodio è stato utilizzato per distruggere l’eccesso di azide di sodio rimanente dopo la fase di sintesi. Il nitrito di sodio è infatti un noto agente decontaminante di sodio azide in condizione acide. Tuttavia in condizioni acide, il nitrito di sodio forma acido nitroso, che reagisce con il residuo di dimetilammina in dimetilformamide, il solvente utilizzato nella reazione di formazione del tetrazolo, e genera NDMA.
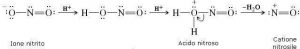
CININDIA HA UN COSTO PER LA SALUTE DEL PAZIENTE?
Cosa potrebbe essere successo invece nel caso indiano della ranitidina? Senza dubbio se vogliamo individuare le ragioni della crisi ormai decennale dello stabilimento ex Bristol oggi Corden Pharma di Via del Murillo (Sermoneta Scalo), dobbiamo ricercarle nei minori costi sostenuti da Big Pharma nell’acquistare materie prime direttamente dai mercati asiatici. Tutto questo ha un costo in termini di tutela della salute del paziente?












